







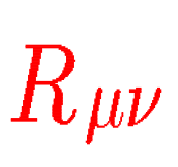

 |
フーコー振り子 |  |
ジャイロホイール |  |
トムソンリング |  |
まぼろしの壁 |  |
回折 |  |
電子雲 |  |
月の軌道 |  |
HR図 |  |
霧箱・サイクロトロン | 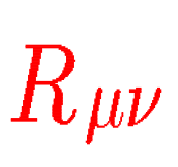 |
一般相対性理論概要 |  |
素粒子標準理論概要 |
| [概説] | 原子構造 | 分子構造 | 水素原子の発光スペクトル | [理論解析] | シュレーディンガー方程式 | 電子軌道 | 国立科学博物館で学ぶ物理学 ホーム |
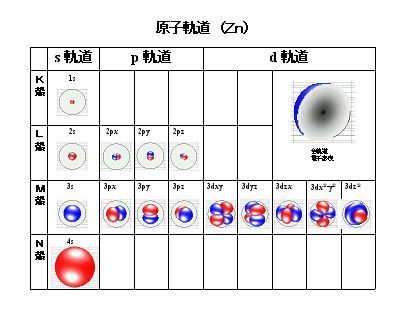
 国立科学博物館の展示には、左図のような模型があります。原子の構造に若干でも興味ある人にはその意味が分かると思いますが、殆どの人には
「何?これ!」程度のものでしょう。
国立科学博物館の展示には、左図のような模型があります。原子の構造に若干でも興味ある人にはその意味が分かると思いますが、殆どの人には
「何?これ!」程度のものでしょう。
高校の物理で習う原子の構造は、太陽(原子核)の周りを回る惑星(電子)のようなものですが、現実には、電子が円形運動をすると 、この円形運動は加速度運動であるため、電磁波を放射してエネルギーを失い、電子はあっという間に原子核に落ち込んで、原子は崩壊してしまいます。 そこで、ボーアは、電子の軌道は飛び飛びの値しか持ちえないとして、下右図のような模型(これをボーア模型と言う)を考えました。 しかし、ボーア模型は電子の持つ波動性を説明することができません。
この不都合を解決した理論が、シュレーディンガー方程式です。名前だけでもご存知の方も多いのではないでしょうか。
シュレーディンガー方程式によれば、電子の位置は確率的で明確にどこにいるかは不明で雲のような状態となります。またその電子の軌道(雲)のエネルギーは連続的でなく
飛び飛びの値しか持ちえません(このことを量子化されたエネルギーと言います)。
このように、電子軌道の描像は、常識では考えれないものとなっているのです。しかし、このように理解することで、分子の状態も計算で定量的に理解されるようになっています。
下左図は、シュレーディンガー方程式を発展させた分子軌道法による亜鉛原子の軌道を、下右図は、水素からネオンまでの原子のボーア模型の軌道を示しますが、 現実は、同一エネルギーの軌道であっても、ボーア模型のように一つの軌道に3つ以上の電子が入ることはないのです。


上の軌道図では、蝋燭の炎を見るようで、それぞれの軌道のまたその内部の電子分布の状況が分からないので、電子分布の存在をストロボ写真的に捉えた図
(計算方法は、「逆変換法」参照)も使用されています。
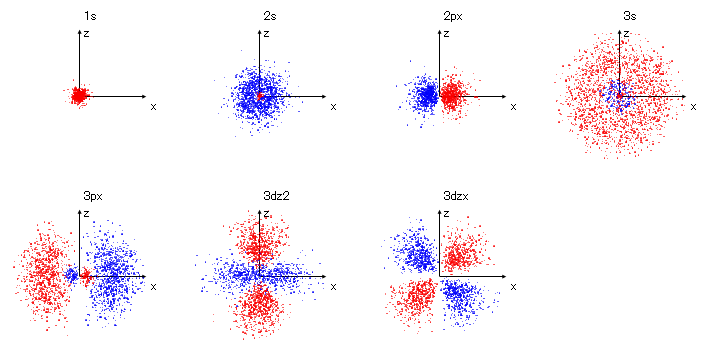
下左図が電子の3次元分布を2次元平面(x-z平面)に投影した図です。赤点と青点は波動関数の正負を意味しますが電子の存在確率の観点からは
違いはありません。赤と青の領域の境界付近は電子の存在確率が低い部分になります。各電子軌道の電子分布が、 1s(1層球状態)、2s(2層球・球殻状態)、3s(3層球・球殻状態)、
2px(1層2葉状態)、3px(2層各2葉状態)、3dz2(円環・瓢箪2葉状態)、3dzx(1層4葉状態)のようになっているのが分かります。この図を回転自在の動画にすれば視覚的にもっと分かり易く
なります。更にこの手法を用いて3次元模型(クリスタルグラスに2方向からレーザービームを当てその交点部分のみ溶解して点を得る)とするのが一番分かり易い方法です。
実際「Nebula」という名称で販売されており、国立科学博物館の売店にもあります。下右図はそこで得た写真です。

(b)分子構造/分子軌道法(詳しくは「量子化学計算勉強室」を見てください)
シュレーディンガー方程式そのものだけでは、原子・分子の構造は分かりません。シュレーディンガー方程式をベースに原子・分子すなわち多電子系の物質の電子構造を
明らかにする方法が分子軌道法と言うものです。ここではその詳細は説明しませんが、この方法を用いると原子・分子についていろいろなことが分かります。
① 分子の電子雲
例えば、水やベンゼンの原子の構造ならびに電子配置の状態は、以下の図のように計算で求めることが出来、H2Oでは∠HOH=104°であることが分かります。
軌道の数で言えば、水の場合、全部で10ヶの電子が、1つの軌道あたり2ヶづつ入り、計5ヶの軌道となります。LUMOから右(軌道エネルギーε>0)は、現実には存在しません。



<補足>局在化軌道
物理的に意味のある軌道は、上図に示す正準軌道です。高校で習う軌道は上図に示す局在化軌道と称される軌道で、正準軌道から導くことが出来ます。その軌道に物理的意味は有りませんが、
原子の結びつきが理解しやすいので利用されています。上図では、その局在化軌道の存在位置関係がよくわからないので、下図に改めて各局在化軌道の位置関係をわかりやすく示します。
1重・2重・3重結合や、孤立電子対の各軌道がどのようなものかが分かると思います。(ここに示していない分子の各正準軌道の図は、「量子化学計算勉強室」を見てください)

② 分子中のHの電荷
また、分子の電荷状態も下図のように計算で求められます。皆さんがよくご存知のように、H2Oは、Hが+0.183に、Oが-0.366に電荷が偏っていることがわかります。
H2Oは、HとOが引き合い(水素結合という)、結晶(氷)構造が下右図のようになることも計算できるのです。
また、典型的な酸である硝酸HNO3のHの電荷が他に比し大きいことが分かります。すなわちこのH+δがH2Oと結合しH+
として水に溶けて酸性を示すことが分かります。


③ 分子振動と赤外線吸収
下図は、水分子の振動とそれに伴う電磁波の波数(1/cm)を示しています。ピークで表された位置の波長の電磁波(この領域は赤外線の領域です)が吸収され、そのエネルギーに応じた振動形態をとります。

下左図は、国立科学博物館で見ることのできる水素原子の発光スペクトルです。下中央はあるweb siteで見つけた水素原子のスペクトル、下右は
wikipediaに掲載されている水素原子のスペクトルです。
博物館展示物は目盛が若干違い、且つ水素分子のスペクトルも混ざっているのかもしれませんが、基本的には、下右図のようなスペクトル
となる筈のものです。これらの値は、シュレーディンガー方程式の解である電子軌道のエネルギーの差⊿Eから
求める(⊿E=hν=hc/λ、h:プランク定数)ことができます。 ここに示したものはバルマー系列といい、主量子数 n = 6,5,4,3 → 2 への各遷移で現れ、輝線となります。
水素原子が光を吸収するときは、発光の時と同じ波長の光を吸収して、スペクトル上では暗線となります。
| 水素原子<科博展示物> | 水素原子<members3.jcom.home.ne.jp> 右から、波長 : 410(紫),434(青紫),486(水色),656(赤)(nm) 486-656の中間のものは水素分子の発光とのこと |
水素原子<wikipedia> 左から、波長 : 410(紫),434(青紫),486(水色),656(赤)(nm) |
 |
 |
 |
⑤ その他
この他に、シュレーディンガー方程式を多原子分子まで拡張した分子軌道法を用いれば、分子の反応も計算でき、 分子の挙動を詳しく定量的に求めることが出来るようになっています。
シュレーディンガー方程式は、このように現在ではなくてはならない重要な理論のベースになっているものです。この展示物を見過ごさずに、シュレーディンガー方程式について理解を深められてはいかがでしょうか。
、
原子を構成する素粒子(電子・クォーク・ニュートリノ等)の性質は、変分原理をベースに対称性を追求したディラック方程式ですべてが分かるのだそうです。
(見慣れないおまじないのような表記法ですが、そんなものがあるんだという程度で見てください)
<ディラック方程式>
この議論は標準理論概要をご覧頂くとして、ここでは、それ以前にまとめられたシュレーディンガー方程式で、原子を構成する電子がどのような挙動をするかについて説明することにしましょう。
シュレーディンガー方程式は、古典物理学の以下の2式
ここに、E:全エネルギー、U(x,y,z):ポテンシャルエネルギー、m:質量、p:運動量、ψ:波動関数、λ:波長、ν:振動数、h:プランク定数
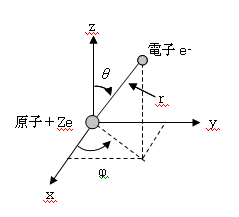
電子は粒子でありながら波の性質をあわせ持つという知見より、この粒子性と波動性を同時に持つ電子の運動状態を右図のように考えます。
なお、Uが時間の関数でない場合は、ψ(x,y,z,t)=φ(x,y,z,t)exp(-iEt/hbar)と置けて、シュレーディンガー方程式は、次のように表される。
シュレーディンガー方程式は、右図のような電子1個のみの原子(水素類似原子という)についてだけ厳密に解くことが出来る。
原子核の正電荷をZe(Z:原子番号、e:電荷)とし、原子核と電子の距離が r であるとき、ポテンシャルエネルギーは、U=-Ze2/(4πε0r)であるから、
シュレーディンガー方程式は、
座標系を球座標(r,θ,φ)とすると、ラプラシアン▽2はやや複雑になり、方程式は次のようになる。(角度φとの混同を避けるために、上で書いたφはψに置き換えた)
以上で準備が整ったので、この方程式を解くことにしよう。
① 動径部分Rの解
式(1)の解は、Laguerreの陪多項式Lr(ρ)
②角部分Φの解
式(2)の解は、簡単に求められて、
③角部分Θの解
式(3)の解は、Legendreの陪多項式Pl(s)
④ (まとめ)シュレーディンガー方程式の実数解
①から③を丹念に計算すれば、全体の実数解は以下のように纏めることが出来る。
①電子存在確率と電子軌道
電子の存在確率密度は、波動関数ψおよびその共役複素数ψ*により、ψ*ψで与えられる。
この軌道図は線画の手法で描いており立体としての様子も分かるようにした図であるが、それぞれの軌道のそのまた内部での濃淡の状態を表すために、
前項(b)④の波動関数χを用いて3次元的な電子の存在を確率的に表す方法がある。このためには、分布関数を乱数で表現しなければならない。
計算機で得られる乱数は出現頻度が一様であるため、波動関数χで求められる確率分布となるような
操作が必要である。この手法を逆変換法と言う。下左図に示すように、確率分布の
累計分布(但し累計が1となるよう規格化しておく)の縦軸に、計算機から得られる乱数を適用し矢印で示す変数ρを求めると、このρは
元の確率分布に従うというものである。
前項(b)④の波動関数χを、その係数を省略して、
実際の計算は、積分解析解を使用すればより正確であるが、簡単には微少量⊿ρ、⊿θ、⊿φに対し積分を和に置き換え、乱数に対するρ、θ、φは、累計分布
で当該乱数を超えた時の値とするような数値計算を行う。
電子軌道のエネルギーは、Hψ=Eψであるから、次式で得られる。( ∫ ψ*ψ dV=1)
水素原子の場合、励起状態の軌道が主量子数nで表される軌道そのものであるので、Z=1 とおいて⊿E = En-E2を求めれば
⊿E = hc/λ(h:プランク定数、c:光速)より、左図のような電子の落ち込み(遷移)を起こす時の放射可視光の波長が求まる。
([Ⅰ](b)④に示した観側値の値を得る)
シュレーディンガー方程式の厳密解が得られるのは、前節で見たように、1電子系の場についてのみである。原子も分子も多電子系であるから、この場を理解するには、
すべての原子ならびにすべての電子間に成り立つシュレーディンガー方程式の和として、
[Ⅱ] シュレーディンガー方程式
(1) 関連する物理法則
<ニュートン方程式/物体の有するエネルギー>
<マックスウェル方程式/電磁波の式>
と、量子論初期の以下の2つの知見
<光量子エネルギー>
<ド・ブローイの物質波>
から、組み立てられている。

(2) シュレーディンガー方程式
電子の粒子性から見て、粒子がベクトルp(運動量p)の方向へ進行しているとき、これを波動性から見ると、電子を形成する波はやはり同じ方向に進行し、
進行方向に垂直な面状では座標x'=r・(p/p)で決まる一定の波動(これを平面波という)を持つと考えます。すなわち、
この式に、E=hν、λ=h/pを代入して、
(p/p)・r=pxx+pyy+pzz であるので、
同様に、y、zの微分を行い和をとると、p2=px2+py2+pz2であるから、
ラプラシアン▽2を用いて書き直すと、
一方、時間微分を行うと、
E=p2/(2m)+U(x,y,z)であるから、上の座標微分と時間微分の式から、以下に示すシュレーディンガー方程式が得られる。
<補足> 演算子
上の説明と同じことであるが、シュレーディンガー方程式は、全エネルギーEの式において、
E、pを演算子(^をつけて表す)に置き換えて、波動関数ψに作用させることで得られる。
ここに、運動量 p、E の演算子(^をつけて表す)は以下の通り。
(3) シュレーディンガー方程式の解

(a) 水素類似原子のシュレーディンガー方程式
ここで、距離とエネルギーを無次元化(無次元化した距離・エネルギーを原子単位au:atomic unit と呼び、以下単に r、E と記し、実距離・実エネルギーを ra、Ea
と記す)に代えると、
参考までにハミルトニアンで書かれたシュレーディンガー方程式を紹介しておこう。上の式を更に変形すると、
この式のに出てくる演算子( )をハミルトニアンといい、Hと書いて、次のように表します。
(厳密には、Hは前項(2)<補足>で言う全エネルギー式 E のことで、その演算子は^を付す必要があるが慣用的に混用している。
Eはその固有値すなわち観測されるエネルギーとしての値である。以下の説明には必要ないので、そうなの程度に見てください。)
(b) 水素類似原子のシュレーディンガー方程式の解
ポテンシャル Z/r が r のみの関数であるから、ψは変数分離が可能で、以下のように置ける。
このように置くと、シュレーディンガー方程式は、分離定数CをC= l(l+1)と置くと、次の2つの方程式となる。
更に、角部分Yの方程式は、
Y(θ,φ)=Θ(θ)Φ(φ)と変数分離できるから、分離定数をmlとすると、この式も更に2つの式となる。
この最後の式は、更に、
と置くと、
を、ρについてs回微分したものLrs(ρ)
を用いて、以下のように与えられる。
但し、
線形微分方程式の解の重ね合わせにより、解の線形結合もまた解であることから、複素関数Φをその線形結合により実数の固有関数とする。
複素形 実数線形結合形
p軌道
d軌道
を、sについてml回微分したものPlml(s)
を用いて、以下のように与えられる。
主量子数
n方位量子数
l磁気量子数
ml殻
軌道
波動関数ψ(r,θ、φ) < 但し、 ρ=(Z/a0)r で表記している。> [ 係数は、規格化( ∫ χ2dV=1)による ]
1
0
0
K
1s
2
0
0
L
2s
2
1
0
L
2pz
2
1
±1
L
2px
2
1
±1
L
2py
3
0
0
M
3s
3
1
0
M
3pz
3
1
±1
M
3px
3
1
±1
M
3py
3
2
0
M
3dz2
3
2
±1
M
3dxz
3
2
±1
M
3dyz
3
2
±2
M
3dxy
3
2
±2
M
3dx2-y2

(c) シュレーディンガー方程式の解の解釈
従い、電子密度ρは、
実数で表した波動関数を用いれば、
電子の存在確率 p は、これを積分して
前項(b)④の式を用いて電子密度を計算し、電子の存在確率が例えば95%となる波動関数一定の面を、軌道の表面(境界)と
見なして図示したものが右の軌道図である。(波動関数そのものをえがいているので、その値の正負を赤・黒で表示)

と表すと、微小部分dVにおける確率は、確率密度 p を用いて、
ρ、θ、φそれぞれについて計算機で得られる乱数に対し、逆変換法でρ、θ、φを求め、次式に代入し電子の存在位置(x,y,z)を得て、図示をすれば冒頭の図
(但し、 x-z平面へ正射影をしている)を描くことができる。
具体的に、各軌道のエネルギーは、前節(b)④「まとめ」に列記した χn++(χ1s、χ2s、χ2p等々)を用い、χが実数で
あることを考慮して、積分すると、
各軌道のエネルギーは飛び飛びの値しかとれず、主量子数 n の値で決まるエネルギーとなる。
但し、Z は原子番号であり、この式で表されるエネルギーは、[Ⅱ](3)(a)で説明した原子単位(au)であることに注意されたい。

従い、バルマー系列の公式は次のようになる。
ここに、
[Ⅴ] 分子軌道法(ハートレーフォック方程式)/多電子系の場
を解く事で、多電子原子や分子の挙動を知ることが出来るが、ここでは論じきれないので、興味のある方は、「量子化学計算勉強室」を見てください。
「国立科学博物館で学ぶ物理学」メニュー
yasuo kawanami

フーコー振り子

ジャイロホイール

トムソンリング

まぼろしの壁

回折

電子雲

月の軌道

HR図

霧箱・サイクロトロン
一般相対性理論概要

素粒子標準理論概要